北京百泰派克生物科技有限公司品牌商
9 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
co-ip-ms需要igg 对照吗?
128 人阅读发布时间:2025-07-26 11:04
一、什么是co-ip-ms?
co-ip-ms是一种生物药物研究领域常用的实验技术,全称为共免疫沉淀质谱(co-immunoprecipitation mass spectrometry)。它结合了共免疫沉淀(co-immunoprecipitation)和质谱分析(mass spectrometry)两种技术,用于研究蛋白质间的相互作用关系。
图1
二、共免疫沉淀的原理
共免疫沉淀是一种通过抗体特异性识别和结合目标蛋白质的技术。在实验中,我们会选择一个特定的抗体,将其与目标蛋白质结合,形成抗原-抗体复合物。然后,通过添加沉淀剂,将复合物沉淀下来。最后,通过洗涤和离心等步骤,将复合物从其他蛋白质和杂质中分离出来。
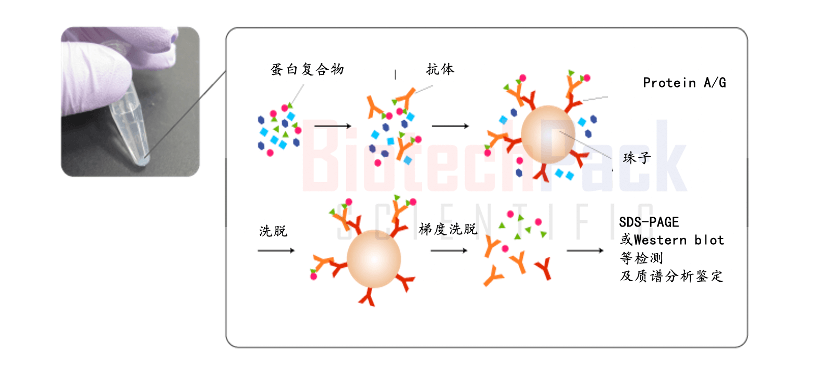
图2
三、质谱分析的作用
质谱分析是一种用于确定物质的分子结构和组成的技术。在co-ip-ms实验中,我们将沉淀得到的复合物进行质谱分析,可以鉴定其中的蛋白质成分。通过质谱分析,我们可以了解目标蛋白质与其他蛋白质之间的相互作用关系,进而揭示生物过程中的信号传递和调控机制。
四、IgG对照的作用
在co-ip-ms实验中,IgG对照是一种常用的实验对照。IgG是一种免疫球蛋白,与目标蛋白质无特异性结合。因此,将IgG作为对照可以帮助我们判断实验结果是否受到非特异性结合的影响。
五、为什么需要IgG对照?
在co-ip-ms实验中,我们常常需要确定目标蛋白质与其他蛋白质的特异性相互作用。然而,由于实验条件的复杂性和蛋白质的复杂性,非特异性结合往往是不可避免的。这种非特异性结合可能会干扰我们对目标蛋白质与其他蛋白质之间真实相互作用的判断。
为了排除非特异性结合的影响,我们需要引入IgG对照。通过将IgG与目标蛋白质一同进行共免疫沉淀,我们可以确定实验条件下非特异性结合的程度。通过对比目标蛋白质与IgG的共沉淀情况,我们可以准确判断目标蛋白质与其他蛋白质的特异性相互作用。
六、IgG对照的作用
在co-ip-ms实验中,引入IgG对照可以起到以下几个作用:
1.评估非特异性结合程度
通过将IgG与目标蛋白质一同进行共免疫沉淀,我们可以确定实验条件下非特异性结合的程度。如果在实验中观察到与IgG的共沉淀,而与目标蛋白质无关的其他蛋白质,那么可以推断这些共沉淀物是由于非特异性结合而产生的。这样,我们就可以准确判断目标蛋白质与其他蛋白质的特异性相互作用。
2.确定特异性相互作用
通过对比目标蛋白质与IgG的共沉淀情况,我们可以进一步确定目标蛋白质与其他蛋白质的特异性相互作用。如果目标蛋白质与IgG的共沉淀较弱或不存在,而与其他蛋白质的共沉淀较强,那么可以推断目标蛋白质与其他蛋白质存在特异性相互作用。
3.提高实验结果的可靠性
引入IgG对照可以帮助我们排除非特异性结合的影响,提高实验结果的可靠性。通过合理设计实验方案,包括选择适当的IgG对照和控制实验条件,我们可以更好地理解蛋白质间的相互作用关系,为生物药物研究提供有力的支持。
在co-ip-ms实验中,IgG对照是一种重要的实验对照。它可以帮助我们评估非特异性结合程度,确定特异性相互作用,并提高实验结果的可靠性。通过合理设计实验方案,引入IgG对照,我们可以更好地理解蛋白质间的相互作用关系,为生物药物研究提供有力的支持。




